商機詳情 -
揚州倍篤生物中鹽核酸酶廠家電話
宿主細胞DNA(HCD)殘留以染色質形式存在,其中有帶負電荷的DNA、帶正電荷及疏水區段的組蛋白,就像膠帶一樣能夠吸附很多物質,包括各種雜蛋白、色譜填料、目的病毒顆粒。非特異吸附雜蛋白,會影響蛋白雜質(如HCP)等的去除;吸附到色譜填料上,會降低色譜分離純化效率;吸附到目的病毒顆粒時,會影響目的產物的穩定性,從而降低目的產物的得率。因此,從生產工藝層面來講,一定要去除HCD,從而能夠簡化工藝、提高目的產物的產量。南京中鹽核酸酶哪家好呢,歡迎咨詢上海倍篤生物 。揚州倍篤生物中鹽核酸酶廠家電話

通過三質粒瞬轉體系生產病毒載體,會引入宿主細胞DNA殘留(HCD)、蛋白殘留(HCP)、工藝雜質(如antibiotics、核酸酶等外源物質)等污染,存在潛在的致瘤性和免疫原性等風險。藥品監管機構一般允許生物制品中存在10ng/dose以下的殘留DNA。此外,根據雜質來源、工藝以及產品類型不同,也會對HCD限度做不同要求。為了達到這個要求,一般通過核酸酶處理和色譜聯用的方法。一般在細胞培養液裂解/收獲、澄清收獲及超濾濃縮等環節加入核酸酶處理,需要工藝摸索來確認處理方式。麗水70960-001中鹽核酸酶供應商江西中鹽核酸酶售后服務哪家好呢,歡迎咨詢上海倍篤生物 。
監管部門對HCD的殘留量有明確的規定。美國FDA發布的指導原則中指出生物制品HCD殘余限度為 100pg/劑,對于大劑量生物制品如單克隆抗體,根據其殘留DNA來源及給藥途徑,殘留量可放寬至 10ng/劑。細胞基因藥物終產品的DNA殘留有兩種來源,分別是宿主細胞DNA(HCD)和轉染用的質粒。質粒和HCD的存在形式不同,去除效率也差別很大。其中,質粒是裸露的DNA雙鏈,帶強負電荷,通過色譜純化主要是離子交換能夠很高效去除;HCD則是以核小體緊密折疊形成的染色質形式存在,幾乎不以裸DNA形式存在,所以很難去除。
宿主細胞DNA殘留的擔憂是基于致ai風險理論,特別是生產細胞系所包含的致ai序列,比如較常見腺病毒基因E1A和E1B(HEK293, PerC.6 和CAP 細胞系),人乳tou瘤病毒E6和E7基因(HeLa細胞系)等。當使用致ai細胞系生產AAV時,下游純化須盡可能減少殘留DNA。工業上一般使用核酸酶分解殘留DNA,普遍認為小于200 bp的DNA片段可有效降低致ai風險。宿主細胞蛋白殘留與免疫原性、炎癥或過敏性休克有關。盡管與非人類的生產原料相比(非人類細胞系如BHK21或昆蟲細胞,以及輔助病毒如HSV、腺病毒、桿狀病毒),人類細胞免疫原性比較弱。中鹽核酸酶哪家好呢,歡迎咨詢我司。
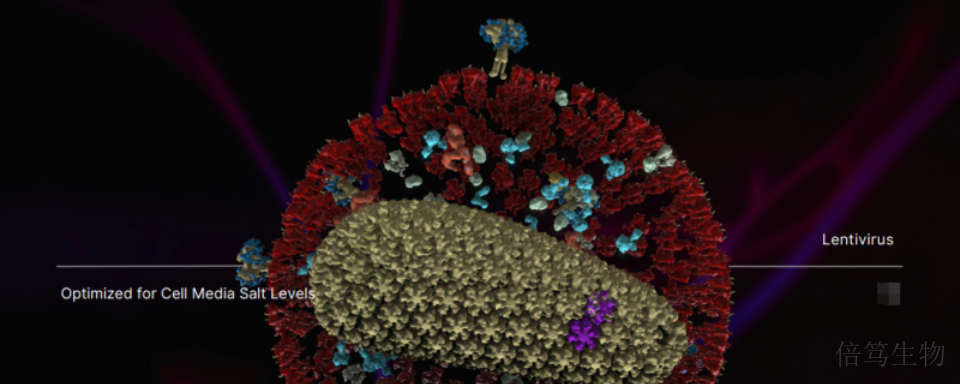
倫敦大學學院(UCL)的工藝開發團隊,在細胞藥物Car-T涉及的慢病毒(Lentivirus,LV)生產過程中,比較了Benzonase和M-SAN HQ中鹽核酸酶在酶活、酶切時間、各階段LV的穩定性等方面的表現,發現在生理鹽條件下M-SAN HQ中鹽核酸酶酶活更高、酶切時間更短,同時用納米顆粒分析(NTA)技術確認M-SAN HQ組得到的LV病毒顆粒聚集更少、穩定性更高。他們會繼續探究HCD是否影響LV的穩定性,及對LV侵染效率和生命周期是否有影響。通過更多研究,我們探究M-SAN HQ中鹽核酸酶助力LV生產的關鍵機制。江西中鹽核酸酶服務哪家好呢,歡迎咨詢上海倍篤生物 。揚州70960-001中鹽核酸酶廠家
相比傳統的全能核酸酶,M-SAN HQ中鹽核酸酶在生理鹽條件下,對HCD的去除效率更高。揚州倍篤生物中鹽核酸酶廠家電話
大規模生產階段,AAV/LV載體生產流程跟抗體、疫苗類藥物的生產類似,主要包含上游培養、下游純化及制劑部分。上游培養分為質粒開發、細胞擴增、三質粒共轉染及病毒載體生產等步驟。下游純化分為細胞裂解釋放AAV病毒顆粒(可以通過去污劑、機械作用、高滲或凍融操作等)or收獲細胞上清液得到含LV病毒原液、加入核酸酶以減少宿主細胞核酸污染、澄清是通過離心或過濾等方法去除細胞碎片和雜質等、超濾濃縮以減少后續色譜純化體系、親合及離子交換等純化得到高純度病毒載體。制劑部分主要是超濾更換緩沖液、過濾除菌及制劑灌裝等。揚州倍篤生物中鹽核酸酶廠家電話